Exemples d'objets phosphorescents

La phosphorescence permet en quelque sorte de stocker de la lumière dans un objet, lumière qui est ensuite émise pendant de longues minutes, voire pendant des heures. La couleur la plus employée est le vert, mais en choisissant de façon adéquate les matériaux, on peut obtenir de la phosphorescence dans le bleu ou le rouge. La phosphorescence est très utilisée dans la signalisation de sécurité, pour indiquer par exemple la direction des issues de secours en cas de panne de courant. Elle sert aussi à la décoration de pièces sombres, des chambres d'enfant ou à Noël. Elle est aussi très pratique pour visualiser les aiguilles des montres, réveils ou horloges dans le noir. On trouve aussi des vernis à ongle phosphorescents, des vêtements, et même des vélos ou du papier toilette !
Exemples d'objets fluorescents
Le "fluo" n'est pas l'apanage des Post-It ou des surligneurs. Des éléments organiques, des teintures de tissus, certains minéraux sont également fluorescents. On trouve aussi des peintures et du maquillage fluorescents.

Pourquoi les vêtements blancs sont-ils fluorescents ?

Certains vêtements blancs ont tendance à jaunir à la longue. Pour contrecarrer ce jaunissement, il faut rajouter une teinte de couleur complémentaire au jaune, c'est à dire bleue, afin de ré-équilibrer le blanc. Autrefois, on colorait l'eau de rinçage du linge avec des « boules bleues », ce qui permettait d'obtenir un linge plus blanc, mais encore un peu grisâtre. On insère maintenant dans les produits de lessive des azurants optiques : ce sont des matériaux fluorescents qui, sous l'action de la lumière ultraviolette, émettent de la lumière bleue. Les vêtements paraissent donc particulièrement blancs sous l'éclairage naturel du soleil, quand il y a beaucoup d'UVs. Mais aussi en boite de nuit, sous les projecteurs de lumière noire, qui accentuent la fluorescence du vêtement.
Quand la fluorescence est invisible en lumière naturelle...
En choisissant judicieusement le matériau fluorescent, on peut faire en sorte que la couleur vive associée à la fluorescence soit invisible à la lumière blanche. On peut alors en faire des éléments de sécurité : les fils fluorescents insérés dans les billets de banque n'apparaissent que sous la lumière UV. De même pour les logos des cartes de crédit ou des chèques bancaires.

La lumière
La lumière visible est une onde électromagnétique, c'est à dire qu'elle est à la fois une onde et un corpuscule appelé photon. On peut donc la caractériser à la fois par les propriétés de l'onde – la longueur d'onde ou la fréquence – et par celles du corpuscule – son énergie. Longueur d'onde, fréquence et énergie sont reliées par des relations très simples, car elles sont en fait les différentes facettes d'une même propriété, qui est la couleur. Toutes les ondes électromagnétiques ne sont pas visibles par l'œil humain. C'est le cas par exemple de l'infrarouge, des ondes radios ou des rayons X par exemple. La seule différence entre la lumière visible et ces autres ondes électromagnétiques est leur « couleur ». Alors que les ondes radio ont une longueur d'onde de plusieurs millimètres ou centimètres, ou que les rayons X ont des longueurs d'onde au plus de 10 nanomètres, la lumière visible se situe entre 400 et 800 nanomètres, de l'indigo au marron. Ou, si l'on préfère, du violet foncé au rouge très foncé. L'énergie d'un photon est inversement proportionnelle à cette longueur d'onde : chaque photon de la lumière indigo renferme donc deux fois plus d'énergie que chaque photon de la lumière marron.
Pour en savoir plus, voir les kezakos « Comment fonctionnent les radars automobiles », « D'où viennent les couleurs changeantes des ailes de papillons », « Comment fonctionne une IRM », « Pourquoi le ciel est bleu » et « Comment fonctionne un écran LCD »
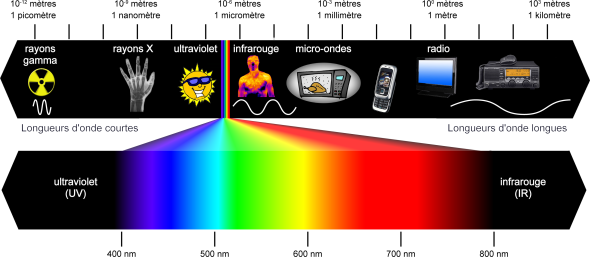
L'énergie d'un atome
On peut se représenter un atome comme un noyau autour duquel tournent des électrons. La lumière est capable de modifier l'énergie totale de l'atome en modifiant l'énergie des électrons. Cette variation d'énergie ne se fait pas n'importe comment. En effet, lorsqu'un électron est libre, il se comporte comme une balle de tennis. On peut le lancer à n'importe quelle vitesse, et il peut donc prendre n'importe quelle valeur d'énergie cinétique. Cette énergie est ainsi continue.
C'est bien différent quand cet électron se trouve « piégé » dans un atome. Son énergie devient quantifiée, c'est à dire qu'il ne peut acquérir que certaines valeurs d'énergie bien précises, et que toutes les autres lui sont interdites : les énergies autorisées sont appelées des niveaux d'énergie. Quand tous les électrons sont à leur niveau d'énergie la plus basse possible compte tenu de la structure de l'atome, on dit que l'atome est dans son niveau d'énergie fondamental. En fournissant la bonne quantité d'énergie, on peut ensuite excité un des électrons sur un premier niveau d'énergie, que l'on peut noter. On dit alors que l'atome est dans son premier niveau excité, que l'on peut noter. On doit ensuite fournir une quantité d'énergie supplémentaire pour atteindre le deuxième niveau excité, et ainsi de suite. Les écarts entre niveaux d'énergie ne sont pas identiques, et l'atome ne pourra jamais avoir une énergie intermédiaire entre deux niveaux d'énergie successifs. L'ensemble des valeurs possibles de l'énergie constitue le « spectre d'énergie » de l'atome.
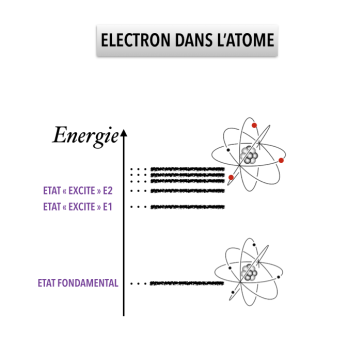
Interaction atome - lumière
La couleur d'un objet, la pomme de l'épisode par exemple, correspond à la couleur des photons qu'il ré-émet quand on l'a éclairé. On l'observe à l'échelle macroscopique, mais il faut analyser ce phénomène à l'échelle de l'atome pour bien le comprendre. !
Cela s'explique à l'échelle microscopique à l'aide du spectre d'énergie des atomes qui constituent l'objet. Pour simplifier, supposons qu'il n'existe que deux états, un état de basse énergie EInf et un état supérieur d'énergie plus élevée, égale à ESup. L'électron ne peut prendre que ces deux valeurs d'énergie, et aucune autre. Pour passer d'une valeur à une autre, l'électron absorbe ou émet de la lumière, c'est à dire un photon.
Un électron de l'atome peut passer d'un état non excité à un état excité en absorbant un photon, en gagnant de l'énergie. Mais ce photon doit avoir une énergie exactement égale à △E = ESup - EInf. Or comme l'énergie d'un photon correspond à une longueur d'onde donnée, le photon absorbé a une couleur bien précise. Par exemple, si l'énergie d'excitation de l'atome correspond à l'énergie de la lumière bleue, seule la lumière bleue sera absorbée.
Mais au fait, que devient l'énergie emmagasinée par l'atome ? Elle est en fait très vite restituée par l'atome, car un état excité n'est pas stable, et l'atome se désexcite donc plus ou moins rapidement. Elle peut être restituée de trois façons différentes : sans ré-émettre de la lumière, en ré-émettant de la lumière, ou un peu des deux.
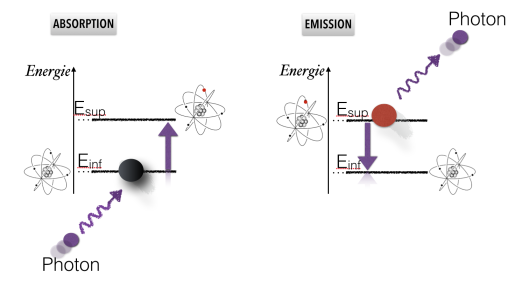
Si l'atome se désexcite sans émettre de lumière (on parle de transition non radiative), l'énergie est ré-émise le plus souvent sous forme thermique : le matériau chauffe. Reprenons l'exemple de l'objet qui absorbe la lumière bleue : si l'on éclaire un tel objet avec de la lumière blanche, et que la désexcitation de l'atome se fait de façon non radiative, la lumière qui reviendra sera de la lumière blanche à laquelle on a soustrait le bleu, et donc de la lumière jaune. Notre objet apparait donc jaune.
Si l'atome se désexcite en émettant de la lumière, le lumière ré-émise ne peut être que de la même couleur que la lumière absorbée. Tout se passe alors comme si le matériau n'avait pas absorbé la lumière, mais l'avait simplement réfléchie. Le phénomène d'absorption suivi d'une émission est appelé la diffusion, et l'on parle d'ailleurs de réflexion diffuse pour le comportement de la lumière dans ce cas là. Pour notre objet jaune, c'est en fait ce qui se passe pour toutes les autres couleurs que le bleu.
Enfin, l'atome peut se désexciter partiellement sans émettre de lumière, puis finalement se désexciter complètement en ré-émettant un photon. Il faut bien sûr qu'il existe un niveau d'énergie intermédiaire, et dans ce cas, le photon ré-émis a une énergie plus faible que le photon absorbé, il a donc une longueur d'onde plus élevé : c'est les phénomènes de fluorescence et de phosphorescence.
Pour conclure, regardons maintenant le spectre réel d'un atome, on peut analyser les différentes interactions lumière-matière qui sont possibles. Concentrons nous par exemple sur les 5 premiers niveaux d'énergie de l'atome d'hydrogène. Si l'atome est dans un état excité à une énergie E2, alors il peut émettre un photon dont l'énergie est égale à E2-E1, ce qui correspond à un photon de couleur rouge. De la même façon, si l'atome est à l'état E1 mais qu'un photon de couleur bleue arrive sur lui, il peut lui céder de l'énergie et l'exciter au niveau 3.
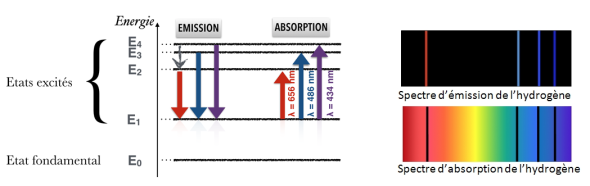
Durée de vie d'un niveau
Le temps que met un atome pour ré-émettre un photon absorbé est un processus aléatoire. On ne peut donc que définir le temps moyen passé par l'électron dans son niveau excité : c'est ce qu'on appelle le temps de vie du niveau. Tous les niveaux atomiques ont un temps de vie, sauf bien sûr le niveau fondamental, qui est stable. Ces temps de vie peuvent varier de quelques milliardièmes de seconde à plusieurs heures, et c'est justement le temps de vie du niveau intermédiaire qui va différencier la fluorescence de la phosphorescence.
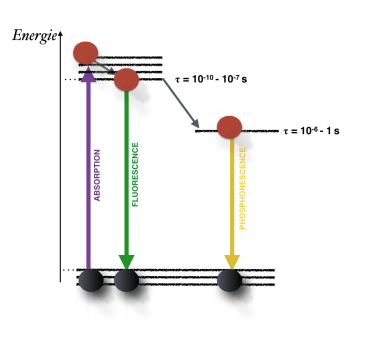
Pour la fluorescence, ce temps de vie est très court. Aussitôt que l'atome est excité par l'absorption d'un photon, la désexcitation se met en place. Cela donne lieu à une transition non radiative (la flèche grise), puis à une émission d'un photon d'énergie plus faible donc de longueur d'onde plus grande. Finalement, l'électron se retrouve à l'état initial en ayant émis un photon vert.
Dans le cas de la phosphorescence, la transition non radiative vers l'état intermédiaire est toujours rapide. Mais c'est cet état intermédiaire qui a une longue durée de vie. Le retour à l'état initial se fait donc beaucoup plus lentement, en moyenne. En moyenne, ce qui signifie que certains électrons ré-émettront de la lumière très vite, et d'autres plus tard : l'objet reste lumineux pendant une longue période après que la lumière d'excitation ait été éteinte.
Durée de vie d'un niveau
Le temps que met un atome pour ré-émettre un photon absorbé est un processus aléatoire. On ne peut donc que définir le temps moyen passé par l'électron dans son niveau excité : c'est ce qu'on appelle le temps de vie du niveau. Tous les niveaux atomiques ont un temps de vie, sauf bien sûr le niveau fondamental, qui est stable. Ces temps de vie peuvent varier de quelques milliardièmes de seconde à plusieurs heures, et c'est justement le temps de vie du niveau intermédiaire qui va différencier la fluorescence de la phosphorescence.

Pour la fluorescence, ce temps de vie est très court. Aussitôt que l'atome est excité par l'absorption d'un photon, la désexcitation se met en place. Cela donne lieu à une transition non radiative (la flèche grise), puis à une émission d'un photon d'énergie plus faible donc de longueur d'onde plus grande. Finalement, l'électron se retrouve à l'état initial en ayant émis un photon vert.
Dans le cas de la phosphorescence, la transition non radiative vers l'état intermédiaire est toujours rapide. Mais c'est cet état intermédiaire qui a une longue durée de vie. Le retour à l'état initial se fait donc beaucoup plus lentement, en moyenne. En moyenne, ce qui signifie que certains électrons ré-émettront de la lumière très vite, et d'autres plus tard : l'objet reste lumineux pendant une longue période après que la lumière d'excitation ait été éteinte.
Durée de vie d'un niveau
Le temps que met un atome pour ré-émettre un photon absorbé est un processus aléatoire. On ne peut donc que définir le temps moyen passé par l'électron dans son niveau excité : c'est ce qu'on appelle le temps de vie du niveau. Tous les niveaux atomiques ont un temps de vie, sauf bien sûr le niveau fondamental, qui est stable. Ces temps de vie peuvent varier de quelques milliardièmes de seconde à plusieurs heures, et c'est justement le temps de vie du niveau intermédiaire qui va différencier la fluorescence de la phosphorescence.

Pour la fluorescence, ce temps de vie est très court. Aussitôt que l'atome est excité par l'absorption d'un photon, la désexcitation se met en place. Cela donne lieu à une transition non radiative (la flèche grise), puis à une émission d'un photon d'énergie plus faible donc de longueur d'onde plus grande. Finalement, l'électron se retrouve à l'état initial en ayant émis un photon vert.
Dans le cas de la phosphorescence, la transition non radiative vers l'état intermédiaire est toujours rapide. Mais c'est cet état intermédiaire qui a une longue durée de vie. Le retour à l'état initial se fait donc beaucoup plus lentement, en moyenne. En moyenne, ce qui signifie que certains électrons ré-émettront de la lumière très vite, et d'autres plus tard : l'objet reste lumineux pendant une longue période après que la lumière d'excitation ait été éteinte.
Interaction atome - lumière
La couleur d'un objet, la pomme de l'épisode par exemple, correspond à la couleur des photons qu'il ré-émet quand on l'a éclairé. On l'observe à l'échelle macroscopique, mais il faut analyser ce phénomène à l'échelle de l'atome pour bien le comprendre. !
Cela s'explique à l'échelle microscopique à l'aide du spectre d'énergie des atomes qui constituent l'objet. Pour simplifier, supposons qu'il n'existe que deux états, un état de basse énergie EInf et un état supérieur d'énergie plus élevée, égale à ESup. L'électron ne peut prendre que ces deux valeurs d'énergie, et aucune autre. Pour passer d'une valeur à une autre, l'électron absorbe ou émet de la lumière, c'est à dire un photon.
Un électron de l'atome peut passer d'un état non excité à un état excité en absorbant un photon, en gagnant de l'énergie. Mais ce photon doit avoir une énergie exactement égale à △E = ESup - EInf. Or comme l'énergie d'un photon correspond à une longueur d'onde donnée, le photon absorbé a une couleur bien précise. Par exemple, si l'énergie d'excitation de l'atome correspond à l'énergie de la lumière bleue, seule la lumière bleue sera absorbée.
Mais au fait, que devient l'énergie emmagasinée par l'atome ? Elle est en fait très vite restituée par l'atome, car un état excité n'est pas stable, et l'atome se désexcite donc plus ou moins rapidement. Elle peut être restituée de trois façons différentes : sans ré-émettre de la lumière, en ré-émettant de la lumière, ou un peu des deux.

Si l'atome se désexcite sans émettre de lumière (on parle de transition non radiative), l'énergie est ré-émise le plus souvent sous forme thermique : le matériau chauffe. Reprenons l'exemple de l'objet qui absorbe la lumière bleue : si l'on éclaire un tel objet avec de la lumière blanche, et que la désexcitation de l'atome se fait de façon non radiative, la lumière qui reviendra sera de la lumière blanche à laquelle on a soustrait le bleu, et donc de la lumière jaune. Notre objet apparait donc jaune.
Si l'atome se désexcite en émettant de la lumière, le lumière ré-émise ne peut être que de la même couleur que la lumière absorbée. Tout se passe alors comme si le matériau n'avait pas absorbé la lumière, mais l'avait simplement réfléchie. Le phénomène d'absorption suivi d'une émission est appelé la diffusion, et l'on parle d'ailleurs de réflexion diffuse pour le comportement de la lumière dans ce cas là. Pour notre objet jaune, c'est en fait ce qui se passe pour toutes les autres couleurs que le bleu.
Enfin, l'atome peut se désexciter partiellement sans émettre de lumière, puis finalement se désexciter complètement en ré-émettant un photon. Il faut bien sûr qu'il existe un niveau d'énergie intermédiaire, et dans ce cas, le photon ré-émis a une énergie plus faible que le photon absorbé, il a donc une longueur d'onde plus élevé : c'est les phénomènes de fluorescence et de phosphorescence.
Pour conclure, regardons maintenant le spectre réel d'un atome, on peut analyser les différentes interactions lumière-matière qui sont possibles. Concentrons nous par exemple sur les 5 premiers niveaux d'énergie de l'atome d'hydrogène. Si l'atome est dans un état excité à une énergie E2, alors il peut émettre un photon dont l'énergie est égale à E2-E1, ce qui correspond à un photon de couleur rouge. De la même façon, si l'atome est à l'état E1 mais qu'un photon de couleur bleue arrive sur lui, il peut lui céder de l'énergie et l'exciter au niveau 3.

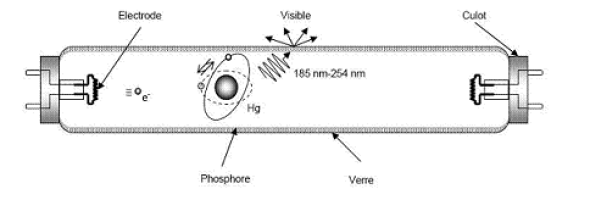
Le principe des tubes fluorescents
Le tube fluorescent, comme sont nom l'indique, fonctionne sur le principe de la fluorescence : c'est donc de la lumière ultraviolette qui produit par fluorescence de la lumière visible. Pour produire la lumière UV, on remplit le tube de vapeur de mercure, et on envoie une décharge électrique pour exciter les atomes. Ceux ci émettent en se désexcitant un rayonnement contenant de l'UV, mais aussi d'autres couleurs, notamment dans le bleu, le vert et le jaune. Ce rayonnement vient frapper les parois du tube, enduites d'une poudre fluorescente composée par exemple de terbium et d'europium. Ces deux éléments émettent de la fluorescence dans le bleu et le vert pour le terbium, et dans le rouge pour l'europium. L'ensemble de la lumière visible, émise par le mercure et les poudres fluorescentes, donnent au final une lumière blanche. En fonction le la composition exacte de la poudre fluorescentes, on peut obtenir des blancs plus ou moins chauds.
La méduse Aequorea Victoria
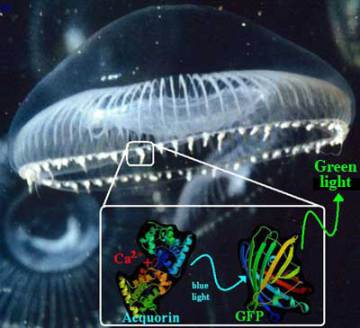
On rencontre la méduse Aequorea Victoria sur la côte ouest des États-Unis, notamment dans la région de Vancouver [1]. Cette méduse produit une lumière verte depuis des petits organes situés à l'extrémité de son ombrelle [2]. Le processus d'émission se déroule en deux temps, comme dans un tube fluorescent . Une première protéine, l'aequorine, émet des flashs bleus, débordant légèrement dans l'UV, en présence de calcium [3,4]. Il s'agit ici de bioluminescence, c'est à dire d'émission de lumière résultant d'une réaction biochimique (voir le kézako). Une deuxième protéine, fluorescente, absorbe la lumière émise par l'aequorine et ré-émet de la lumière verte. Cette protéine est simplement appelée protéine fluorescente verte, abréviée GFP (de l'anglais). La découverte de cette protéine a révolutionné l'imagerie médicale : son gène peut en effet être fusionné au gène d'une protéine que l'on veut étudier, puis réintroduit dans des cellules, qui vont alors synthétiser une protéine fluorescente [5]. Grâce à la microscopie de fluorescence, on peut alors étudier les protéines dans les cellules vivantes. En 2008, le japonais Osamu Shimomura et les américains Martin Chalfie et Roger Tsien ont été récompensés par le prix Nobel de chimie pour la découverte et le développement de la protéine fluorescente verte [6].
Références
[1] Un article très complet (en anglais) de Claudia E. Mills
[2] Une page du Connecticut College (en anglais) sur le prix Nobel Osamu Shimomura
[3] Comment le calcium régule la luminescence de la méduse
[4] Structure and Spectra in Bioluminescence, John Lee and Eugene S. Vysotski
[5] Une introduction aux protéines fluorescentes (en anglais)
[6] Prix Nobel de Chimie 2008 : une méduse fluorescente récompensée.