Le sablage
Le sablage est une technique alternative au salage. Il ne permet pas de faire fondre la neige, mais il augmente l'adhérence. Le sable déversé se met à la surface et recrée alors un sol adhérent. Cette technique est surtout utilisée dans les pays nordiques ou sur les routes peu fréquentées. Malheureusement, elle a aussi un impact écologique.
Pour en savoir plus sur la notion d'adhérence, voir le site de la main à la pâte ou cette conférence de Lydéric Bocquet.
Les états de l'eau
L'eau se trouve sous différentes formes dans la nature : pluie, brouillard, neige, verglas... On distingue principalement trois états de l'eau : l'état solide (neige, glace, grêle...), l'état liquide (pluie, brouillard, buée, rosée...) et l'état gazeux, la vapeur d'eau que l'on ne peut pas voir à l'œil nu. À la pression atmosphérique, c'est à dire environ 1 bar, l'eau bout à 100°C et se transforme en glace à 0°C. Ces changements d'état dépendent fortement de la pression, et donc de l'altitude. Ainsi, la température d'ébullition de l'eau diminue d'environ 1°C tous les 300 m. Par exemple, à 3000 m d'altitude, l'eau bout à 90 °C.
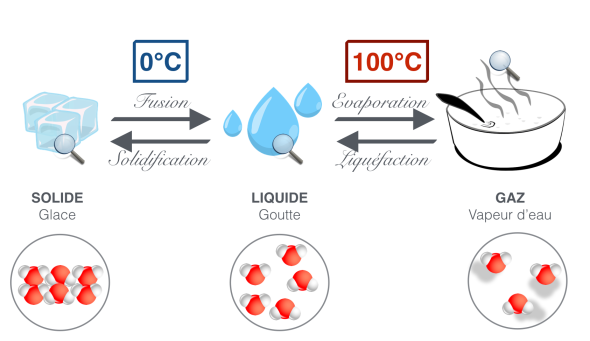
Si l'on observe de plus près la structure de l'eau dans les différents états, on peut comprendre le processus de changement d'état. Plus on apporte de la chaleur aux molécules d'eau, plus on leur donne de l'énergie. Elles acquièrent ainsi une certaine vitesse. À l'état gazeux, les molécules vont donc très vite et prennent toute la place qu'elles peuvent, elles sont libres. Plus l'on refroidit les molécules, plus elles ralentissent. À 100°C et 1 bar, elles commencent alors à ressentir l'influence de leurs voisines, et une certaine cohésion se crée. Elles bougent toujours beaucoup, mais leur mouvement est restreint, c'est l'état liquide. À 0°C et 1 bar, elles bougent de moins en moins, et se rapprochent les unes des autres. La cohésion se renforce, et c'est l'état solide. Pour en savoir plus, regardez le kézako De quoi est composée la matière ? Pourquoi est ce solide, liquide ou gazeux ?
La température de fusion d'un mélange
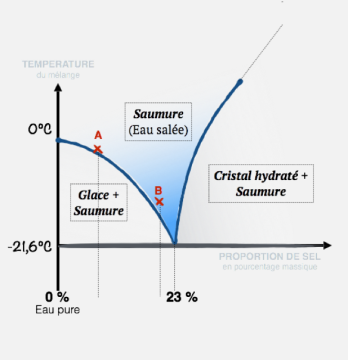
La température Tc de congélation ou de fusion de l'eau pure est égale à 0°C. Cependant, lorsque l'on mélange l'eau à une espèce chimique ou à une impureté, cette température peut évoluer. On peut représenter l'évolution de Tc en fonction de la quantité de soluté ajouté.
Par exemple, on peut regarder l'évolution de Tc de l'eau en fonction de la quantité de sel ajouté à pression atmosphérique. Ce type de diagramme est appelé « diagramme binaire » par les chimistes, car il s'agit d'un mélange de deux constituants. Si l'on se réfère au graphique ci-dessous, on peut voir qu'à 0% de sel, on retrouve la température de fusion de l'eau pure égale à 0°C. Si maintenant on ajoute un peu de sel et que l'on se situe au niveau du mélange A (environ 10% de sel ajouté), on voit que l'on retrouve bien -6,6°C. Et avec 20% de sel, en B, le mélange gèle à -16,2°. Enfin, la température de congélation la plus basse, -21°, est obtenue avec 23% de sel. Lorsque l'on se situe en dessous de -21°C, on observe de la glace et un cristal de sel hydraté qui sont deux solides non miscibles.
La dissolution du sel dans l'eau
Lorsque l'on met du sel dans de l'eau, il se dissout. En effet, il passe d'un état solide cristallin à un état « liquide ». Pourtant, pas de fusion à l'horizon, son point de fusion étant à une température supérieure à 800°C. En fait, l'eau l'a désolidarisé, et les constituants du cristal (le sodium Na et le chlore Cl) sont alors sous forme d'ions dans la solution. On va le voir, ce processus de dissolution n'est pas instantané, c'est pour cela qu'il est intéressant d'utiliser de la saumure : de l'eau dans laquelle on a déjà dissout du sel. Enfin, il s'accompagne généralement d'un dégagement de chaleur.
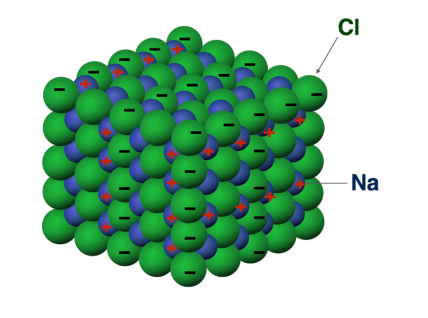
La structure du cristal de chlorure de sodium est particulière : il s'agit d'un « cristal ionique », c'est à dire que ses forces de cohésion sont des forces ioniques, des forces dues aux charges de ses constituants Na et Cl. D'une part, Cl a tendance à capter des électrons, d'autre part, Na, lui, en cède. Leur équilibre à l'état solide est donc basé sur ces interactions. Cl est plus gros car il a plus d'électrons, et Na plus petit car il en a moins. On parle de cristal car il a une structure très ordonnée.
La dissolution du sel dans l'eau peut être divisé en 3 étapes qui se passent en même temps (cette vidéo du Musée Canadien de la Nature est très illustrative) :
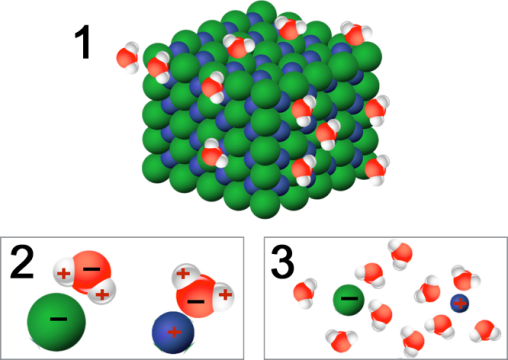
La molécule d'eau, qui elle même a des charges, va attirer chacun des constituants différemment. Elle attire les atomes de chlore (Cl) par ses hydrogènes chargés positivement. De même, elle va « décrocher » les atomes de sodium (Na) grâce à sa partie négative portée par l'oxygène. La molécule d'eau va donc « ioniser » le cristal.
En isolant chacun des constituants, elle se met au travers des deux ions et diminue alors considérablement les interactions entre Na et Cl.
Elle va finir par les isoler de plus en plus, et surtout les hydrater. C'est la phase d'hydratation.
Il y a cependant une limite de solubilisation. Si l'on met une quantité trop importante de sel dans l'eau, il ne se dissoudra plus, car l'eau ne sera plus capable de diminuer les interactions entre les ions. Cette limite dépend notamment de la température.
L'eau et la glace de mer
L'eau de mer contient en moyenne 35 g de sel par litre, ou plus précisément 35 g de sel par kilogramme d'eau de mer, et donc, pour reprendre les unités de l'épisode, l'eau de mer contient 3.5% de sel. Cette salinité varie d'une mer à l'autre : par exemple, la mer Baltique est plutôt moins salée, avec un taux de 3.1 %, voire même moins de 1% pour les eaux de surface, tandis que la Méditerranée est plus salée, avec un taux de 3.8 % au large de la Provence. La méditerranée est donc 6 fois moins salée que la saumure, qui contient 23% de sel. Il existe cependant sur Terre des mers et des lacs salés qui dépassent cette concentration : c'est le cas de la mer Morte, dont la salinité s'élève à 33%.
Aux grandes latitudes, lorsque l'hiver arrive, la mer gèle, formant la banquise. Cette glace de mer est donc salée, mais en pratique, il se forme dans la glace des petites poches de saumure, qui à la longue, tombent littéralement (rappelons que l'eau est plus lourde que la glace) sous la banquise. La glace de mer perd donc de sa salinité avec le temps.

Les fondants routiers
Les fondants routiers sont les matériaux que répandent les saleuses sur les routes pour faire fondre la neige ou le verglas, ou pour les empêcher de se former. Il existe de nombreux fondants routiers, mais en France, on utilise dans 99% des cas le chlorure de sodium, soit sous forme solide (le sel), soit sous forme liquide (la saumure), soit sous la forme d'un mélange de sel et de saumure, ce qu'on appelle la bouille de sel. Cette dernière présente l'avantage d'être maniable mécaniquement par les appareils, mais aussi de faire fondre la neige plus rapidement grâce la saumure liquide. Enfin le chlorure de calcium est un très bon fondant car lors de la dissolution il dégage beaucoup de chaleur, ce qui permet en plus d'assécher la chaussée, mais il reste peu utilisé car il présente d'autres contraintes.
Pour en savoir plus, consultez le site du gouvernement français dédié à la viabilité hivernale, notamment ce cours de physique sur les fondants routiers, et cette page donnant de nombreuses informations sur les différents produits.
Les fondants routiers
Les fondants routiers sont les matériaux que répandent les saleuses sur les routes pour faire fondre la neige ou le verglas, ou pour les empêcher de se former. Il existe de nombreux fondants routiers, mais en France, on utilise dans 99% des cas le chlorure de sodium, soit sous forme solide (le sel), soit sous forme liquide (la saumure), soit sous la forme d'un mélange de sel et de saumure, ce qu'on appelle la bouille de sel. Cette dernière présente l'avantage d'être maniable mécaniquement par les appareils, mais aussi de faire fondre la neige plus rapidement grâce la saumure liquide. Enfin le chlorure de calcium est un très bon fondant car lors de la dissolution il dégage beaucoup de chaleur, ce qui permet en plus d'assécher la chaussée, mais il reste peu utilisé car il présente d'autres contraintes.
Pour en savoir plus, consultez le site du gouvernement français dédié à la viabilité hivernale, notamment ce cours de physique sur les fondants routiers, et cette page donnant de nombreuses informations sur les différents produits.